1. O que é CRISPR e as cirurgias de DNA
O DNA pode ser considerado o nosso “código fonte”. Nas mais de 3 bilhões de letrinhas (os As, Ts, Gs e Cs) que compõem nosso genoma, estão todas as informações necessárias para produzir a estrutura biológica que nos define e que, somada às experiências e à interação com o ambiente, define nossos traços comportamentais. Algumas vezes, nessa infinidade de letras (para ter ideia, quando desdobradas e alinhadas, as moléculas de DNA de uma única célula possuem aproximadamente 1,8m de comprimento!), variações podem ser herdadas ou introduzidas de forma com que a informação ali contida introduz um erro, gerando uma “linha de comando” não funcional. Esse erro no nosso código fonte leva muitas vezes ao desenvolvimento das chamadas doenças genéticas.
Existem mais de 6000 doenças genéticas identificadas. Anemia falciforme, atrofia medulo-espinhal, coreia de Huntington, distrofia muscular de Duchenne, fibrose cística (para citar algumas). Todas estas doenças compartilham do fato de serem causadas por mutações genéticas e, por essa razão, não possuem tratamento eficaz disponível.
Individualmente, estas doenças podem ser consideradas raras (de frequência populacional muito baixa), porém, em conjunto, estima-se que 1 em cada 50 pessoas no mundo são portadoras de doenças genéticas raras. Entretanto, esse cenário triste e desafiador encontrou em 2012 um novo raio de esperança. Um estudo liderado por duas brilhantes pesquisadoras, Jennifer Doudna e Emmanuelle Charpentier, desvendou o mecanismo molecular de como bactérias eram capazes de se defender de fagos (vírus que infectam bactérias) e produzir uma resposta de memória, sistema este chamado de CRISPR-Cas.
A quem se interessar, recomendo a leitura do livro “A decodificadora”, que conta sobre a vida de Jennifer Doudna e os bastidores da descoberta. Em 2022, completamos 10 anos da publicação original do estudo (1)
Aqui, tentarei explicar como uma proteína de uma bactéria super comum se tornou a esperança de muitos pacientes; o que foi e vem sendo desenvolvido com essa tecnologia; e as inovações no setor da saúde humana catalisadas por essa descoberta.
2. Como a tecnologia funciona e o que muda do que é feito atualmente
Desde a elucidação da estrutura do DNA em 1953 por Watson, Crick e Franklin, passando pelo desenvolvimento dos primeiros métodos de sequenciamento por Sanger em 1977 e a tecnologia do DNA recombinante na década de 80, imaginávamos um dia sermos capazes de modificar a sequência de DNA, quem sabe até corrigindo mutações que causam doenças. Parece muito simples e lógico, né? Se o problema é que ao invés de um T eu tenho um G na posição 564 do gene X, para solucionar o problema de vez é só mudar de volta de G para T na mesma posição 564 do gene X! Sim, na teoria é “só” isso que precisa.
Na prática é outra coisa. Realizar essas alterações até 2012 era MUITO complexo, caro e pouco eficiente, o que limitava este tipo de pesquisa a pouquíssimos laboratórios no mundo. A técnica mais avançada até então, chamada de TALENs e ZINC fingers, necessitava, para realizar uma única alteração no DNA, da produção de uma proteína para cortar o DNA na região específica, para então poder modificá-lo, e isso é muito trabalhoso e pouco eficiente.
As bactérias possuem um sistema muito mais inteligente de cortar o DNA em uma região específica. Elas produzem uma classe de proteínas que possuem essa atividade de cortar o DNA, chamadas de “Cas”. Estas Cas’s se associam a pequenas moléculas de RNAs. Estes RNAs, por complementariedade, “levam” esta proteína até a região específica de DNA desejada, possibilitando a Cas cortar o DNA precisamente naquele local.
Quando infectadas por fagos, as bactérias processam e introduzem fragmentos do DNA do próprio fago que a infectou no seu próprio DNA. Essa molécula de DNA do fago inserida servirá de molde para a produção do RNA mencionado anteriormente. Desta forma, toda vez que a bactéria for infectada pelo fago que possui aquela mesma sequência de DNA, será reconhecida e terá a o seu DNA cortado, evitando a replicação do fago e a infecção da bactéria.
Produzir uma molécula de RNA pequena é MUITO fácil e barato, porém, como podemos aplicar esta mesma tecnologia para cortar o DNA de mamíferos – como nós mesmos -, produzindo para isso uma molécula de RNA para direcionar esse sistema para um gene com uma mutação causadora de doença?
E foi com esta pergunta e um experimento muito simples e elegante que as pesquisadoras mencionadas, e depois diversos colegas no mundo, mostraram que essa tecnologia poderia ser aplicada em células de mamíferos, incluindo nós, humanos. Estava aberta, então, a era da edição genética.
3. Dados de mercado sobre a tecnologia
Estima-se que o mercado global de tratamento para doenças raras seja de 195 bilhões de dólares com um crescimento anual composto de 8,5% (2). O mercado de ferramentas de diagnóstico baseadas no CRISPR é estimado em 1,8 bilhões de dólares com crescimento projetado de 30% ao ano (3)! Estes são apenas alguns exemplos que mostram a amplitude de potenciais aplicações e oportunidades em mercados sólidos e crescentes.
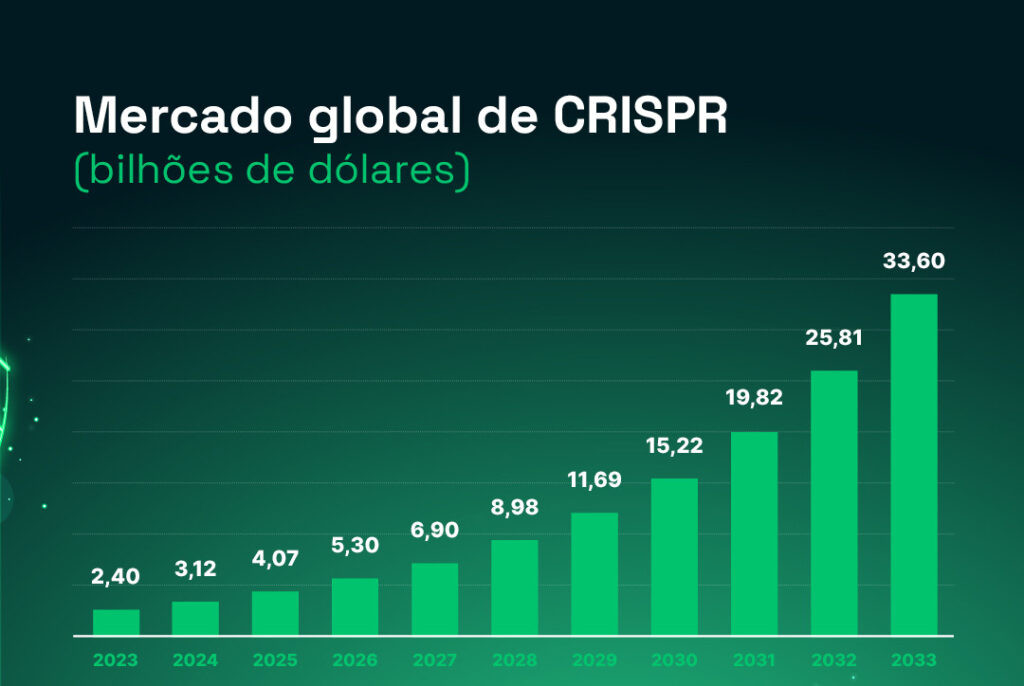
Estima-se que o mercado global de tratamento para doenças raras seja de 195 bilhões de dólares com um crescimento anual composto de 8,5% (2). O mercado de ferramentas de diagnóstico baseadas no CRISPR é estimado em 1,8 bilhões de dólares com crescimento projetado de 30% ao ano (3)! Estes são apenas alguns exemplos que mostram a amplitude de potenciais aplicações e oportunidades em mercados sólidos e crescentes.

A tecnologia de CRISPR tem gerado um salto muito grande nestes mercados que possuem uma demanda reprimida alta. O cenário de propriedade intelectual dessa tecnologia foi inicialmente marcado por uma disputa travada entre a Universidade da Califórnia – Berkley e o MIT, sendo o último o vencedor da disputa. O uso da ferramenta, como inicialmente desenvolvida para finalidades terapêuticas, está protegida. Porém, como em outros setores e em especial na área biotecnológica, diversas modificações do sistema inicial, novos processos e novas aplicações potencializam os desenvolvimentos de novas propriedades intelectuais que aquecem e inundam o mercado de inovação.
4. Como esta tecnologia têm sido tratada no Brasil
Nosso grupo na USP tem utilizado esta tecnologia para a modificação genética de suínos para tornar os órgãos destes animais compatíveis com o transplante em humanos, os chamados xenotransplantes, visando eliminar no futuro as filas de espera para transplante de órgãos. O Brasil possui o maior sistema público de transplante de órgãos (via SUS), possuindo uma fila de espera de aproximadamente 49.000 brasileiros inscritos, muitos destes, vêm a falecer sem conseguir realizar o transplante, infelizmente.
Já produzimos os primeiros embriões suínos geneticamente modificados e estamos agora construindo uma estrutura de produção de animais para atender a essa finalidade em parceria com o Instituto de Pesquisas Tecnológicas (IPT) e FAPESP. No ano de 2022, os primeiros casos de xenotransplantes em humanos foram relatados nos EUA. Apesar das limitações, os resultados obtidos aumentaram muito a esperança de que esta abordagem terá sucesso em um futuro breve. No xenotransplante, é possível ver o efeito da revolução introduzida pelo sistema CRISPR. Até 2013, poucos grupos conseguiam desenvolver abordagens como esta, os quais ainda tinham resultados modestos. Com a aplicação do acesso à tecnologia e aumento da eficiência do processo com o advento do CRISPR, a sobrevida média de primatas em ensaios pré-clinicos aumentou, em média, aproximadamente 10 vezes (7).
5. Próximos passos e oportunidades para a tecnologia
Umas das preocupações é a ocorrência de off-targets, ou cortes inespecíficos, que não são nada desejáveis. Para controlar isso, a proteína Cas vem sendo modificada por meio de engenharia de proteínas. Como exemplo, temos o sistema PRIME editing (5) que é muito mais preciso do que o sistema original. Temos também a Cas fusionada a outras proteínas, como deaminases para fazer a substituição de uma base nitrogenada sem a necessidade do corte de DNA, etc.
O sistema original CRISPR-Cas funciona muito bem para inativar genes, mas para inserir genes ou sequências muito longas, nem tanto. O recente sistema denominado de PASTE (6) consegue inserir cópias únicas em um único sítio de inserção programável. Estes são exemplos de como a Cas9 original vem sendo trabalhada e melhorada ao longo dos últimos anos.
Outro grande desafio é conseguir fazer edições gênicas in vivo, ou seja, no próprio paciente. “Entregar” o sistema de edição ao tecido alvo é um grande desafio ainda, assim como em outras abordagens de terapia gênica. A própria natureza da doença em questão afeta o desenvolvimento de novas terapias. Por exemplo, a fibrose cística é uma doença que pode ser causada por diferentes mutações no mesmo gene (chamado de CFTR), e não uma mesma mutação, como no caso da anemia falciforme. Chamamos isso de heterogeneidade alélica. Logo, desenvolver uma única terapia para todos os pacientes com fibrose cística tende a ser muito mais desafiador, em especial se pensarmos em escala.
Quando pensamos em CRISPR e saúde humana pensamos imediatamente em terapias para doenças genéticas. Entretanto, esta tecnologia pode ser utilizada em diferentes outras áreas dentro da saúde, como na área de transplante de órgãos, diagnósticos de precisão, tratamentos para doenças infecciosas, câncer e muitos outros.
6. Referência
- 1. Jinek M, Chylinski K, Fonfara I, Hauer M, Doudna JA, Charpentier E. A programmable dual-RNA-guided DNA endonuclease in adaptive bacterial immunity. Science. 2012 Aug 17;337(6096):816-21. doi: 10.1126/science.1225829. Epub 2012 Jun 28. PMID: 22745249; PMCID: PMC6286148.
- 2. https://www.gminsights.com/industry-analysis/rare-disease-treatment-market
- 3. https://www.futuremarketinsights.com/reports/crispr-and-cas-gene-market#:~:text=The%20newly%20released%20CRISPR%20and,higher%20than%20the%20historical%20growth.
- 4. https://www.thebusinessresearchcompany.com/report/xenotransplantation-global-market-report#:~:text=The%20global%20xenotransplantation%20market%20size,(CAGR)%20of%208.1%25
- 5. Anzalone, A.V., Randolph, P.B., Davis, J.R. et al. Search-and-replace genome editing without double-strand breaks or donor DNA. Nature 576, 149–157 (2019). https://doi.org/10.1038/s41586-019-1711-4
- 6. Yarnall, M.T.N., Ioannidi, E.I., Schmitt-Ulms, C. et al. Drag-and-drop genome insertion of large sequences without double-strand DNA cleavage using CRISPR-directed integrases. Nat Biotechnol (2022). https://doi.org/10.1038/s41587-022-01527-4
- 7. Cooper, D.K.C. (2020). Introduction: The Present Status of Xenotransplantation Research. In: Costa, C. (eds) Xenotransplantation. Methods in Molecular Biology, vol 2110. Humana, New York, NY. https://doi.org/10.1007/978-1-0716-0255-3_1

Ernesto Goulart
PhD Pesquisador Departamento de Genética – Instituto de Biociências da USP





